放射線治療について(一般の方へ)
リニアックについて
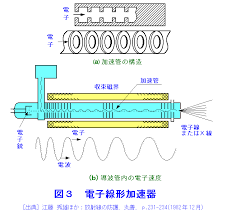
粒子を一直線上で加速するものを線形加速器と呼びます。ライナック(linac)やリニアック(lineac)とも呼ばれることがありますが、いずれも英語で線形加速器を意味する"Linear Accelerator"からの造語です。商品名とも言われています。
基本的な構造は多数の導体筒を並べたもので、隣り合った導体筒同士が異符号に帯電するように高周波電圧を印加します。それぞれの筒の間(以下ギャップと称す)では電場が存在するので粒子に力が働きます。一方筒の内部は一様電位なので電場が存在せず粒子は力を受けない。筒の長さと印加する高周波の周波数をうまく調整することで、筒の中を通る粒子がギャップを通過するたびに加速させることが可能になります。
この方式でエネルギーの大きなものを作ろうとすると加速器の長さを長くする必要があります。したがって、限られたスペースで高エネルギーを必要とするときはサイクロトロンやシンクロトロンが用いられてきました。
しかしながら技術の進歩により短い距離で高エネルギーを得ることができるようになり、リニアックが外部放射線治療装置としての座を占めています。
線量単位 Gy(グレイ)
放射線を受けた物質は、放射線のエネルギーを吸収します。単位質量当たりで吸収したエネルギーから、「放射線量」を表すことができます。これが「吸収線量(absorbed dose)」で「(Gy)グレイ」 という単位で表します。放射線治療での投与線量も、Gy(グレイ)という単位で表します。基本的な治療として、1日1回2Gyを20日~30日かけて行います。がん種や部位および状態により1回の投与量や回数は医師の裁量により決定されます。
1Gyは、物質1kgあたり1ジュールのエネルギー吸収があるときの吸収線量であり、放射線の種類、物質の種類に関係なく使用されます。なお、ジュールはエネルギーの単位で、1カロリー=4.184ジュールです。国際放射線防護委員会(ICRP)は、人体の吸収線量について、特定の臓器や組織が吸収する放射線エネルギーをその重量で割って、「1kg当たり平均1ジュールのエネルギーを吸収する放射線量」を1Gyと定義しています。
吸収線量は物質が吸収した放射線のエネルギー量。1グレイは、放射線の照射により物質1kgあたり1ジュールのエネルギー吸収があるときの線量をあらわす。
国際放射線単位測定委員会(ICRU)の要請を受けて、1975年、国際度量衡委員会(CIPM)は放射線吸収線量の国際(SI)単位として固有の名称「グレイ」を用いることを決定しました。
このグレイという単位は、ルイス・ハロルド・グレイ(Luis Harold Gray)にちなんでつけられました。グレイは1905年、イギリスのロンドンで労働者階級の家庭に生まれました。小学校の成績が抜群であったことから奨学金を得て、パブリックスクールを経て、ケンブリッジ大学トリニテイカレッジに進学しました。その後大学も優秀な成績で卒業し、大学の実験物理学研究所として優秀な人材を集めていたキャベンディッシュ研究所の研究員となりました。
グレイが研究所に入った1929年当時の所長は、ラザフォードで、直接指導に当たったのは後に中性子を発見するチャドウィックでした。宇宙線やガンマ線と物質との相互作用の研究で多くの業績を残したグレイは、1933年、チャドウィックの仲介でロンドンのマウント・バーノン病院へ転職します。がん治療に用いるX線とガンマ線の、人体への線量を測定するため、物理学者が求められたのでした。
グレイは子供の頃から物理学に興味を示し、生物学には関心がありませんでした。にも関わらず、当時としては珍しい病院物理士として、生物物理学分野に転職したのは、母親の妹と恩師夫人をがんで亡くした若い日の体験が動機であったと推測されています。
X線やガンマ線を照射した物質中でのエネルギー吸収は、生成された二次電子の電離作用を通じて行われます。その電離を測定するために、固体物質に小さな空洞を作り、そこに特定の気体を封入して、その気体中で電気量を測定します。グレイは、その電気量を固体物質の吸収線量に換算する方法を開発して、「ガンマ線エネルギーの絶対測定のための電離方法」という論文を1936年に発表しました。これが「ブラッグ・グレイ(Bragg・Gray)の理論」と言われるものです。
1938年には、あらゆるタイプの電離放射線に等しく適応できる線量単位を、リードと共に定義しました。のちに1953年、国際放射線単位測定委員会(ICRU)が吸収線量単位として「rad(ラド)」と命名した単位に相当するものでした。国際(SI)単位の吸収線量の特別な呼称として「グレイ」が用いられた原点が、ここにあるとされています。1グレイ=100ラドです。
高精度放射線治療
理想の放射線治療とは何でしょうか?それは腫瘍のみに放射線をあてて、周りの正常組織には放射線をあてない治療だと言われています。しかし、体の外から放射線をあてる以上、腫瘍のみに放射線をあてる事は原理的に不可能です。ですが近年の放射線治療技術の進歩は著しく、理想の放射線治療に近づくため様々な治療技術が開発されています。その中でも最近よく耳にする強度変調放射線治療(IMRT:Intensity Modulated Radiation Therapy)と画像誘導放射線治療(IGRT:Image Guided Radiation Therapy)について紹介したいと思います。
従来の治療法の場合、放射線の強度は均一なので腫瘍への放射線量を増やすと周りの正常組織にあたる放射線の量も増え、そのぶん副作用の発生率も増加します。しかしIMRTという技術は、放射線の強度を変化させて不均一にする事が出来ます。そのため放射線を腫瘍に集中させつつ、正常組織への放射線量は極力減らすということが可能になります。つまり、IMRTは従来の治療法に比べて、副作用の発生率を抑えつつ腫瘍の制御率を上げることが可能な治療なのです。このIMRTで最も重要になってくるのは位置合わせの精度です。もし位置合わせにズレが生じるとどうなるでしょうか。放射線の強度を変化させているため、放射線が腫瘍に十分にあたらず、正常組織にたくさんあたってしまうという危険性があるのです。そこで開発されたのがIGRTという技術です。治療の直前に治療寝台に寝たまま画像(X線写真、CT等)を取得し、位置誤差を補正するという手法です。体表面のマークで位置を合わせる従来の位置合わせに比べ、体の中の構造物(骨や臓器)で直接位置合わせが出来るため、精度の高い位置合わせが可能になります。IMRTとIGRTを組み合わせる事でより安全で高精度な放射線治療が可能となり、理想の放射線治療にまた一歩近づいたのではないかと思います。
(鳥取大学医学部附属病院放射線部 小林 仁)
サイバーナイフ&トモセラピー
鳥取県内では、まだ導入がない装置ですが高精度放射線治療装置として特異的な機能をもつ2つの放射線治療装置を紹介します。
みなさんは自動車工場などで使われている産業用の溶接ロボットをご存知でしょうか。自動車のフレームの様々な部分でロボットが自由自在に動きバチバチっと効率よく溶接を行う様子をテレビなどで見かけることがあります。「サイバーナイフ」はそのロボットアームに放射線発生装置を組み込んだような構造になっています(図)。患者は寝台に寝ているだけで、ロボットアームががんの部分を中心に様々な角度から放射線を照射できるように設計されています。通常の放射線治療装置よりも照射方向が多様なため、正常組織への影響を避けながら集中的に放射線をがん組織へ照射することが可能です。
この装置には軍事技術が応用されています。ずいぶん昔の話になりますが、レーガン大統領が進めてきたスターウォーズ計画という核ミサイルを宇宙で撃墜し防衛しようという壮大な計画がありました。冷戦の終結により計画は中止となり多くの科学者が放出され民間の企業へ流れていきました。その中の弾道ミサイルへ照準を合わせる技術がこのサイバーナイフへ導入されています。核ミサイルではなく「がん組織」をターゲットとし、呼吸や体動による動きを補正しながら正確に照射する様子はSF映画のようです。
もうひとつ形の変わった放射線治療装置に「トモテラピー」があります。
CT装置のような形をしており体のまわりを回転しながら放射線を照射します。この装置の大きな特徴は形通りCTを撮影しながら照射をおこなうという点です。また頭の先から骨盤まで連続した非常に長い範囲の治療においても寝台を動かしながら継ぎ目のない照射が可能です。
科学技術の進歩とともにさまざまな放射線治療装置や治療技術が開発されています。今回紹介した2つの装置も「正確な位置」に「線量を集中」するという目的は同じです。
鳥取県においてもこれらの最新技術が享受できる環境が待たれます。
(鳥取県立中央病院中央放射線室 砂川知広)
ガンマナイフ
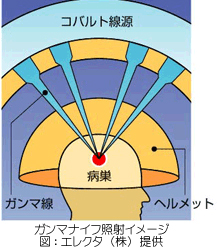
ガンマナイフとは、脳の治療を専門とした定位放射線治療の装置です。半円状のヘルメットの様な装置に201個のコバルト60が配列されており、ここから出るガンマ線のビームを脳の病変部に集中させることにより治療します。
むしめがねで太陽の光を集め紙を焼くのとよく似ています。この時病変の大きさや形にあわせて4種類のコリメーター(4・8・14・18mm)の穴があいたお椀のようなもの)を使用します。一本一本のガンマ線は細いものなので、病変部まで通過する際の皮膚や正常な脳組織に与える影響は最小限に抑えることが出来ます。ガンマ線の集中する中心部だけ効果を及ぼすことができるのです(図参照)。(誤差は0.2mm程度)
 治療の流れとしましては、まず頭部に専用の固定フレームを装着します。この際局所麻酔下において4箇所頭部にピンで固定します。その後MRI・CT・血管撮影など必要な検査を行い病変の正確な3次元データーを計測し治療計画を立てます。治療対象の大きさ、数、種類等によって治療時間は異なりますが治療は一日で終了します。頭部のフレームを外した後は通常の生活ができ、翌日には退院します。基本的に2泊3日の入院で治療を行います。その後は定期的にMRIやCTで病変部を観察する必要があります。
治療の流れとしましては、まず頭部に専用の固定フレームを装着します。この際局所麻酔下において4箇所頭部にピンで固定します。その後MRI・CT・血管撮影など必要な検査を行い病変の正確な3次元データーを計測し治療計画を立てます。治療対象の大きさ、数、種類等によって治療時間は異なりますが治療は一日で終了します。頭部のフレームを外した後は通常の生活ができ、翌日には退院します。基本的に2泊3日の入院で治療を行います。その後は定期的にMRIやCTで病変部を観察する必要があります。
ガンマナイフが適応となる脳疾患は転移性脳腫瘍などの悪性腫瘍、聴神経腫瘍・髄膜腫・下垂体腺腫といった良性腫瘍、脳動脈奇形などの脳血管障害等あります。特に一番多く治療されているのが転移性脳腫瘍です。また腫瘍の数や大きさによっては治療の適応外となりますが、外科的手術が難しい部位では、適応外とされてきた直径3cm以上の腫瘍でも何回かに分ける分割照射を行うことによって治療を行う場合があります。ご相談は高島病院ガンマナイフセンターにご連絡下さい。
(医療法人育生会 高島病院放射線科 西村泰之)
粒子線治療
粒子線とは陽子(水素イオン)や重粒子(炭素イオン)のように電荷をもった粒子が束状になった放射線を指し、その発生に特殊な装置が必要なことから限られた施設でのみ放射線治療を行っています。一般病院ではX線、ガンマ線のように発生が容易な電磁波を用いています。X線、ガンマ線は人体へ向けて照射すると体表から浅いところで放射線量が高く、深くなるにつれて低くなります。それに対し粒子線は浅いところで放射線量が低く、一定の深さで急に高くなりそれより深くは進まないという性質があります(図を参照下さい)。
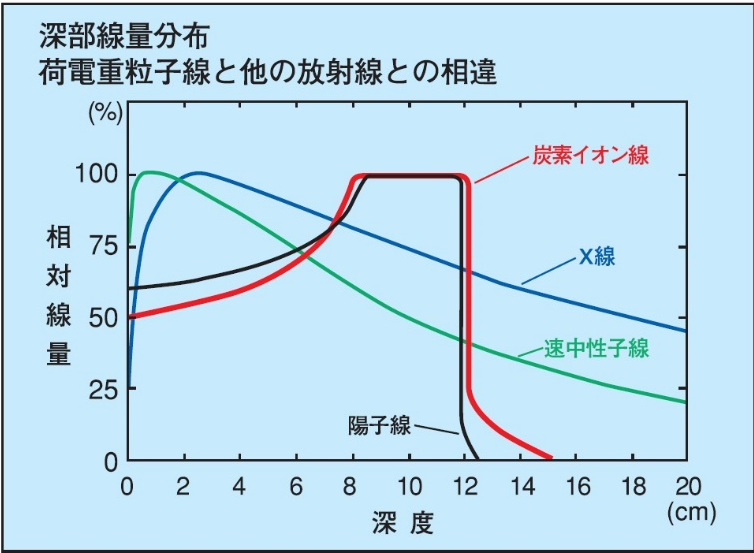 体の奥にあり手術が困難な場合や重要な器官に隣接して通常の放射線治療では難しいがんに対して有効で、周囲の正常組織を傷つけることなくがん病巣のみを狙い撃ちすることができます。特に重粒子線は、X線や陽子線に比べて更に細胞への破壊力が強く、治りにくい抵抗性を示すがんにも効果的です。
重粒子線治療による3年局所制御率(治療により腫瘍が縮小した、もしくは腫瘍の成長が止まった割合)を御紹介します。早期非小細胞肺がんは90%を上回っており、肝がんでは70~90%、また、前立腺がんではほぼ100%と高い治療効果となっています。
体の奥にあり手術が困難な場合や重要な器官に隣接して通常の放射線治療では難しいがんに対して有効で、周囲の正常組織を傷つけることなくがん病巣のみを狙い撃ちすることができます。特に重粒子線は、X線や陽子線に比べて更に細胞への破壊力が強く、治りにくい抵抗性を示すがんにも効果的です。
重粒子線治療による3年局所制御率(治療により腫瘍が縮小した、もしくは腫瘍の成長が止まった割合)を御紹介します。早期非小細胞肺がんは90%を上回っており、肝がんでは70~90%、また、前立腺がんではほぼ100%と高い治療効果となっています。
粒子線治療施設は、イオン源、加速器、照射機器、治療室で構成されます。加速器は、陽子、重粒子を数十万回周回加速し、光速の約60~84%まで到達させ、体内におけるがんの深さに最適なエネルギーレベルに調整したものを治療室の患者へ照射します。加速器は、直径9000mの大型のものから、最近では直径15m程度の小型のものまであり、今後はさらに普及していくと考えられます。
単純に照射するだけでなく、呼吸の動きに同期させる高精度な照射方法や、位置決めを短時間化し患者の負担を軽減するために、360度任意の方向から照射ができる回転照射装置を用いた方法も取り入れられています。
このような粒子線治療施設は、日本に15施設あり、山陰近隣では兵庫県たつの市に県立粒子線医療センターがあります。今後、中国四国地方で初めての粒子線治療装置(陽子線タイプ)が2016年3月に岡山県津山市に導入される予定になっています。
粒子線治療は先進医療としてがん治療に高い効果を上げていますが、その技術料は公的医療保険の対象外であり、約300万円の費用は患者の全額自己負担になります。しかし、民間保険会社で先進医療特約を付加した商品も増えてきましたので、上手く利用することで安心して治療に専念できます。
(鳥取県立厚生病院中央放射線室 金光太郎)
【参考文献】独立行政法人 放射線医学総合研究所、編.重粒子線がん治療(HIMAC)
中性子捕捉療法
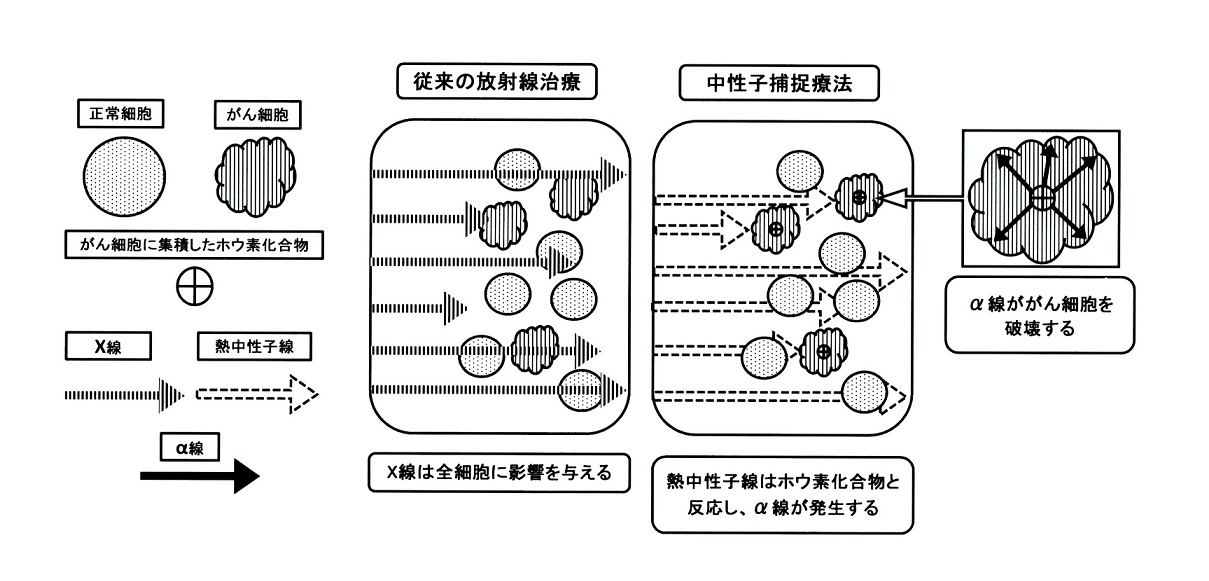
中性子捕捉療法を極々簡単に説明しますと、①癌細胞にホウ素を取り込ませる。②ホウ素に熱中性子を照射する。③ホウ素と熱中性子が核反応を起こして発生する放射線で癌細胞を殺す。という治療法です(参考図)。
 もっと専門的で詳細な原理が知りたい方は、日本中性子捕捉療法学会のホームページなどを参照されるとよいでしょう。。
もっと専門的で詳細な原理が知りたい方は、日本中性子捕捉療法学会のホームページなどを参照されるとよいでしょう。。
さて、この中性子捕捉療法ですが、従来の放射線治療と比較して優れた点をいくつか紹介します。まずは、“癌細胞を選択的に殺傷することができる”ことです。この治療ではホウ素を取り込んだ細胞のみが放射線の影響を受けるためです。次に“放射線に対する抵抗力が強い癌細胞にも効果を発揮する”ことです。ホウ素と熱中性子の核反応によって生じる放射線(α線)は非常に殺傷能力の高い種類のものであるためです。最後に“再発に強い”ことです。一度放射線治療を行った部位は原則として再照射できません。これは一回目の照射で正常な細胞も大きく損傷しているからです。しかし、中性子捕捉療法は前述のとおり、癌細胞のみを選択的に照射しているため、正常細胞に影響はなく、再照射が可能となります。。
良い点をみると、まるで夢のような治療法ですが、現在はまだ薬事承認されていません。それはまだ、この『中性子捕捉療法』が研究段階だからです。“腫瘍に集積性のあるホウ素化合物”や“1秒当たりに非常に多くの中性子が照射できる中性子源(現在は研究用の原子炉)”を筆頭に、多くの課題があるようです。特に原子炉については昨今の“原発問題”以降縮小傾向です。さまざまな課題を克服したそのときこそ、『中性子捕捉療法』は癌治療の主役になるかもしれません。。
(鳥取赤十字病院放射線技術課 木村洋史)